İnsan Vücudunun Kimyasal Yapısı (Temel Fizyoloji 1)
- sspsyonetim
- 20 May 2023
- 26 dakikada okunur
Güncelleme tarihi: 1 Tem 2023
İçindekiler
1. Atomun Yapısı
1.1 Atom Numarası ve Kütle Numarası
1.2 Atomik Kütle
1.3 İyonlar, Bileşikler ve Moleküller
2. Kimyasal Bağlar
2.1 İyonik Bağlar
2.2 Kovalent Bağlar
2.3 Hidrojen Bağları
3. Kimyasal Reaksiyonlar
3.1 Enerji Türleri
3.2 Enerji Aktarımı
3.3 Kimyasal Reaksiyon Türleri
4. İnorganik Bileşikler ve Çözeltiler
4.1 Su
4.2 Asitler, Bazlar ve Tuzlar
4.3 Asit-Baz Dengesi ve Tampon Sistemleri
5. Organik Bileşikler
5.1 Karbonhidratlar
5.2 Lipidler
5.3 Proteinler
5.4 Nükleik Asitler
5.5 Adenozin Trifosfat (ATP)
1. Atomun Yapısı
Her madde kimyasal elementlerden meydana gelmiştir. İnsan vücudunun %96’sı oksijen (O), karbon (C), hidrojen (H) ve nitrojenden (N) oluşmaktadır. Elementler ise atom adı verilen daha küçük yapılardan oluşur.
Atomlar temelde iki (2) kısımda ele alınır. Proton ve nötronları barındıran nükleus, ve nükleus etrafında kabuklarda/katmanlarda dolaşan elektronlar. Nükleusa en yakın olan birinci katmanda en fazla iki (2), ikinci (2) katmanda (8), üçüncü katmanda on sekiz (18) elektron bulunabilir. Elektron katmanları elektronla dolacağı zaman bu olay sırayla olmak zorundadır. Birinci katman iki elektronla dolmadan ikinci katmanda elektron dolaşmaya başlayamaz. İkinci katman elektronla dolmadan üçüncü katmanda elektron dolaşmaya başlayamaz, bu kural böyle devam eder. Sodyum (Na), bu kurala örnek olarak, birinci katmanda 2, ikinci katmanda 8 ve üçüncü katmanda 1 elektron barındırır İnsan vücudunda bulunan en hacimli element, bünyesinde toplamda 58 elektron barındıran iyottur.
Bir elementin atomlarındaki elektron ve proton sayısı birbirine her zaman eşittir. Bu bilgiyle beraber, elektronlar eksi , protonlar ise artı yüklü olduğundan atom elektriksel açıdan dengededir. Bu yüzden atomların toplam elektriksel yükü, elektron sayısının azlığından veya çokluğundan bağımsız olarak, sıfırdır.
GÖRSEL 1 Atomun yapısı: çekirdek ve elektronlar

1.1 Atom Numarası ve Kütle Numarası
Atomun sahip olduğu protonların sayısı atom numarasını verir. Oksijenin atom numarası sekizdir (8) çünkü nükleusunda sekiz (8) proton bulunmaktadır. Çeşitli elementlerin atomları da farklıdır dolayısıyla atom numaraları da farklı olur. Oksijenden farklı olarak sodyumun atom numarası ise on birdir (11) ve siz sebebini artık biliyorsunuz.
Kütle numarası ise atomun sahip olduğu proton ve nötronların toplamını ifade eder. Sodyumun yapısında 11 proton ve 12 nötron bulunduğu için kütle numarası 23'tür. Aynı elementin atomları aynı proton sayısına sahip olsa da nötron sayılarında farklılık olabilir. Bu sebeple bu atomların kütle numaraları da farklı olmaktadır. Bir elementin farklı sayıda nötronlara ve kütle numaralarına sahip olan atomlarına izotop ismi verilir. Bu noktada oksijen örneğini kullanabiliriz. Bazı oksijen atomları 9 veya 10 nötrona sahip olabilir ancak hepsi 8 elektron ve 8 protona sahiptir. İzotopların çoğu kararlı haldedir. Bu, nükleer yapılarının zamanla değişmediği anlamına gelmektedir. Oksijenin kararlı izotopları O-16, O-17 ve O-18 şeklinde belirtilir. İzotoplar farklı sayıda nötrona sahip olsalar da kimyasal özellikleri aynıdır, bunun sebebi aynı sayıda elektrona sahip olmalarıdır. Atomun kimyasal özellikleri sahip olduğu elektronların sayısına bağlıdır.
Radyoaktif izotoplar kararlı halde değildir. Nükleusları kendiliğinden kararlı hale geçebilir. Bu değişme esnasında radyasyon yayarlar ve sıklıkla farklı elementlere dönüşürler. Örnek olarak H-3, C-14, O-15, O-19 verebiliriz.
1.2 Atomik Kütle
Atomun kütlesisini ölçmek için kullanılan standart birim dalton ya da atomik kütle birimi kısaca akb'dir. Bir nötron 1.008, bir proton 1.007 ve bir elektron 0.005 dalton kütleye sahiptir. Elektronların kütlesi proton ve nötronlarla kıyaslandığında neredeyse 2000 kat daha azdır. Bir elementin atomik kütlesi (atomik ağırlık olarak da duyabilirsiniz) doğal olarak bulunan bütün izotoplarının ortalama kütlesidir.
1.3 İyonlar, Bileşikler ve Moleküller
Atomlar, kararlı hale gelebilmek için diğer elementlerin atomlarıyla etkileşime girme çabasındadır. Bu etkileşimlerde her bir elementin atomunun (elektron kaybetme, kazanma, paylaşma gibi) kendine özgü bir davranışı bulunur. Bu alıp-verme veya paylaşma olayları neticesinde insan vücudunda atomların elektriksel açıdan yüklü formları olan iyonlar meydana gelir. İyon, eşit olmayan proton ve elektron sayısına sahiptir, bu yüzden pozitif veya negatif yüke sahip bir parçacıktır. İyonlaşma ise elektron alma veya elektron kaybetme olayıdır. İyon, yazılmak veya sembolize edilmek istendiğinde kimyasal sembolünün yanına artı veya eksi yükü sayısıyla birlikte belirtilir. Buna örnek olarak, 2 elektron kaybetmiş olan kalsiyum iyonu "Ca+2" şeklinde sembolize edilir.
2 veya daha fazla atom elektron paylaştığında oluşan yapı molekül olarak ifade edilir. Bir molekül aynı tür atomlardan oluşabilir. Buna örnek olarak oksijen molekülünü verelim. Oksijen için moleküler formülümüz ise O2dir. O oksijen simgesi için, 2 ise iki adet oksijen atomu olduğunu ifade etmektedir. Bir molekül 2 veya daha fazla farklı tür atomdan da oluşabilir. Buna örnek olarak ise su molekülünü verelim. Bu yapının moleküler formülü ise H2O olarak ifade edilir yani iki hidrojen bir oksijen atomundan oluşan bir moleküldür.
Bileşikler, 2 veya daha fazla farklı tür elementin atomlarından oluşan maddelerdir. Vücudumuzdaki atomların çoğu bileşikler yapısında yer almaktadır. Su (H2O) ve sofra tuzu (NaCl) bileşik yapıda olan maddelerdir. Bunun aksine oksijen molekülü bir bileşik değildir çünkü aynı tür atomlardan oluşur.
Serbest radikal, en dış katmanında eşlenmemiş elektronu bulunan atom veya atom gruplarını belirten bir ifadedir. Buna en yaygın örnek oksijen molekülünün yapısına bir elektron eklenmesiyle oluşan süperoksit molekülüdür. Serbest radikali kararsız, reaktif ve çevre moleküller için yıkıcı yapan şey eşlenmemiş bir elektrona sahip olmasıdır. Bu yapılar başka yapılarla etkileşime geçerek (elektron alarak veya elektron vererek) kararlı hale geçer. Bir serbest radikalin kararlı hale geçme çabası vücut için önemli olan molekülleri parçalayabilir.
GÖRSEL 2 Oksijen molekülü ve süperoksit serbest radikali

Ateroskleroz, alzheimer, amfizem, kanser, diyabet, katarakt, maküler dejenerasyon ve romatoid artrit oksijen kaynaklı ortaya çıkan serbest radikallerle bağlantılı hastalıklar ve durumlara örnektir.
2. Kimyasal Bağlar
Atomları bir arada tutan kuvvete kimyasal bağlar denir. Atomlar bağları en dış kabuklarındaki, diğer adı valans kabuğu, elektron savısına göre yapar. Valans kabuğunda 8 elektron bulunan bir atom kimyasal olarak kararlıdır ve normal şartlarda diğer atomlarla bağ kurmayacak demektir. Neonun, örnek olarak, valans kanuğunda 8 elektron bulunur bu yüzden diğer atomlarla bağ kurması çok da kolay değildir. İnsan vücudunda bulunan ve biyolojik açıdan yüksek öneme sahip olan elementlerin valans kabuğunda 8 elektron bulunmaz. Bu yüzden belli şartlar sağlandığında iki veya daha fazla atom elektronlarını paylaşıp son katmanını 8e tamamlamaya çalışır. 8e tamamlayıp kimyasal anlamda kararlı hale geçme çabası oktet kuralı olarak bilinir.
Hidrojenin atom numarası bir (1)'dir. Bu yüzden, yalnızca bir elektron ve bir protonu bulunur. Hidrojen için oktet değil dublet kuralı geçerlidir (ilk ve tek elektron katmanında 2 elektron olduğunda kararlı hale geçer)
Oktet kuralı sayesinde atomların etkileşimleri öngörülebilirdir. Valans elektron dağılım şekli ne tür bir kimyasal bağ yapıldığını bize gösterir. İyonik bağlar, kovalent bağlar ve hidrojen bağları olmak üzere üç çeşit kimyasal bağı inceleyeceğiz.
2.1 İyonik Bağ
Valans kabuğunun elektron kazanması veya kaybetmesi neticesinde iyonların oluştuğunu daha önce söylemiştik. Zıt kutuplar birbirlerini çektiği için pozitif ve negatif yüklü iyonlar doğal olarak birbirini çeker. Zıt yüklü iyonların birlikte durmasını sağlayan çekim kuvvetine iyonik bağ denir. İyonik bağ için en yaygın örnek sofralarımızda kullandığımız tuz olan NaCl ya da sodyumklorürdür. Sodyumun valans kabuğunda 1 elektron bulunur, bu elektrondan kurtulduğu takdirde proton sayısı elektron sayısından b1 değer daha fazla olur bu yüzden +1 yüklü iyon yapısına geçmiştir. Artık kararlı haldedir çünkü yeni valans kabuğunda toplamda 8 elektron (oktet kuralı) bulunur. Bu durumdaki gibi artı yüklü iyonlara katyon denir. Sodyumun aksine klorun valans kabuğunda 7 elektron bulunur. Bu yüzden klorun kararlı hale geçebilmesi için 1 elektron almaya ihtiyacı vardır. Bu iki elementin atomları birbirine yeterince yaklaştığında, bir tarafta elektron kaybı öbür tarafta elektron kazanımı gerçekleşir. Atomların arasındaki artı ve eksi yük farkı atomları birbirine çeker işte bu çekim kuvveti iyonik bağı ifade eder. Sonuç olarak iki iyondan oluşan ve iyonik bağ ile birbirine bağlı olan bir bileşik elde edilmiştir.
GÖRSEL 3 İyonik bağ örneği: sodyum klorür
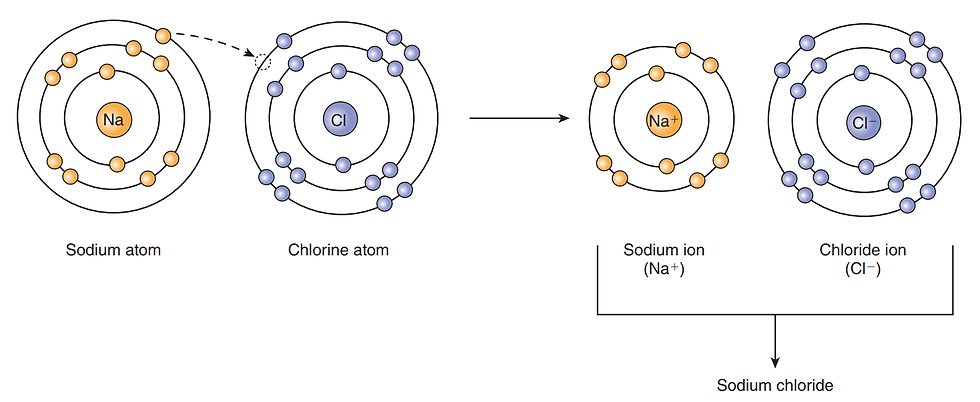
İnsan vücuduna baktığımızda iyonik bağların genellikle diş ve kemik gibi kuvvetli yapısal dokularda bulunduğunu görürüz.
Diyelim ki elinizde bir tane iyonik bileşiğiniz var. Eğer bu bileşik solüsyonda iyonlarına ayrışıyorsa bu bileşiğe elektrolit adı verilir. İnsan vücudunda bulunan iyonların çoğu vücut sıvılarında elektrolitlere çözünür. Elektrolit olarak isimlendirilmelerinin ise mantıklı bir sebebi bulunur, çünkü elde ettiğiniz bu solüsyonlar elektrik akımını iletebilme özelliğine sahiptir.
2.2 Kovalent Bağ
İyonikte görülen elektron kazanma ve kaybetme olaylarının aksine kovalent bağ, 2 veya daha fazla atomun elektronlarının paylaşılması neticesinde oluşan bağdır. Valans elektronunda bulunan 1, 2 veya 3 elektron çiftinin paylaşılmasıyla kovalent bağ gerçekleşebilir. Bu bağın ne kadar kuvvetli olacağını belirleyen şey paylaşılan elektron çifti sayısıyla doğrudan ilişkilidir. Daha büyük boyutlu bir paylaşım daha kuvvetli bir bağ demektir. Bu bağ aynı elementin atomlarından oluşabileceği farklı elementlerin atomları arasında da oluşabilir. Vücudumuzda en çok bulunan bağ türüdür, buna paralel olarak vücut yapılarının çoğuna form kazandıran bileşikler bu bağ ile meydana gelmiştir.
Tekli kovalent bağ iki atom arasında birer elektron paylaşımı sonucu gerçekleşir. Örnek vermek gerekirse, 2 hidrojen atomunun birleşmesi sonucu tekli kovalent bağ ile oluşan hidrojen molekülü meydana gelir. Bu sayede iki atomunda valans kabuğunda her zaman olmasa da zaman zaman iki elektron dolaşacaktır. İkili kovalent bağ ise iki atomun 2şer elektron çifti paylaşması sonucu oluşur ki bunun da en güzel örneği oksijen molekülüdür. Üçlü kovalent bağ ise, artık tahmin edebileceğiniz gibi, üç elektron çiftinin paylaşılması neticesinde oluşur. Buna örnek ise nitrojen molekülünü verebiliriz.
Önceki paragrafta verdiğimiz örneklerden farklı olarak kovalent bağlar farklı elementlerin atomları arasında da gerçekleşebilir. Bunun en güzel örneği bir gaz olan metandır. Metan, yapısında 1 karbon ve 4 hidrojen barındırır. Karbon valans kabuğunu dengelemek için 4 elektrona ihtiyaç duyar. Bu eylem için hidrojene gereken ise 1 elektrondur. Bu yüzden, karbon atomu 4 farklı hidrojenle 1er elektron paylaşır. Bu sayede hem kendisi hem de hidrojenler kararlı hale geçmiş olur ve aralarında paylaşımdan ötürü kovalent bağ bulunur.
GÖRSEL 4 4 farklı tekli kovalent bağ örneği: metan

Kovalent bağlarla ilgili bahsetmemiz gereken bir olay daha kaldı: polar ve apolar kovalent bağlar. Her atomun nükleusu elektronlara aynı oranda çekim kuvveti uygulamaz. Birebir aynı olan iki atom arasında oluşmuş bir kovalent bağı düşünelim, bu durumda elektronlara karşı her iki atomda aynı oranda çekim kuvveti uygular. Atomların elektronlara eşit çekim kuvveti uyguladığı moleküllerde apolar kovalent bağlar bulunur.
Polar kovalent bağda ise bir atomun nükleusu öbür atomun mükleusuna kıyasla elektronlara daha fazla çekim kuvveti uygular. Bu durumda elektronlar iki atomun da çevresinde dönmeye devam eder ancak iki atomun etrafında eşit vakit geçirmezler. Çekim kuvveti daha yüksek olan nükleusun etrafında daha çok vakit geçireceklerdir. Bu yüzden, molekülün yapısında çekim kuvveti daha yüksek olan atomun bulunduğu taraf öbür tarafa kıyasla biraz daha negatif yüklü olacaktır. Bir molekülün yapısında bulunan atomlardan elektronları daha kuvvetli şekilde kendisine çekenlerin elektronegatifliği (elektronları kendine çekme kuvveti) daha yüksek demektir. Polar kovalent bağa sahip bir molekülde bulunan atomlardan birisi kısmi negatif yüke sahipse moleküldeki diğer atomlardan en az bir tanesi kısmi pozitif yüke sahip olmalıdır. Bir molekülün kısmi yüklü kısımları δ+ veya δ- şekilde gösterilir. İnsan vücudunda polar kovalent bağın en güzel örneği su molekülü yapısında bulunan hidrojen ve oksijen arasındaki polar kovalent bağdır. Bu noktada sizlerin fikrini alalım. Elektronegatifliği daha yüksek olan oksijen atomu ise, elektronlar hangi tarafta daha fazla vakit geçirir ve molekülün hangi tarafında kısmi negatif yük bulunur?
GÖRSEL 5 Polar kovalent bağ örneği: su molekülü

2.3 Hidrojen Bağları
Hidrojen atomları ve diğer atomlar arasında oluşan polar kovalent bağlar, üçüncü bir tip olan hidrojen bağlarının oluşmasına olanak tanımaktadır. Peki hidrojen bağı nasıl oluşur? Kısmi pozitif yüke sahip bir hidrojen atomu çevresinde bulunan kısmi negatif yüke sahip yani elektronegatifliği yüksek olan atomları çeker. Zıt olan kısmi yüklü atomlar birbirini çekme eğilimi gösterir ve bu durumda hidrojen bağı oluşmuş demektir. Hidrojen bağının oluşması için, gördüğünüz gibi, elektron kazanma/kaybetme veya paylaşma gibi bir durum söz konusu değildir. Bundan dolayı da hidrojen bağları diğer türlere kıyasla daha zayıf bağlardır. Zayıf oldukları için de atomları moleküllere bağlayabilme yetenekleri yoktur. Bu becerileri olmamasına rağmen çok önemli büyük moleküllerin (örn. nükleik asitler) farklı kısımlarının birbirine bağlanması için yapıya ciddi destek sağlarlar.
GÖRSEL 6 Su molekülleri arasındaki hidrojen bağları

3. Kimyasal Reaksiyonlar
Yeni bağların oluşması veya var olan eski bağların yıkılmasıyla kimyasal reaksiyonlar oluşur. Hidrojen ve oksijen moleküllerinin suyu oluşturmak için nasıl etkileşime girdiklerini bir hatırlayalım. Bu gibi sebeplerden ötürü kimyasal reaksiyonlar tüm yaşamsal faaliyetler için bir temeldir cümlesini kolaylıkla kurabiliriz.
Suyu üretmek için öncelikle bazı maddelere sahip olmamız gereklidir. Bu maddeler elbette ki hidrojen ve oksijen molekülleri. Reaksiyonun gerçekleşeceği maddelere reaktant adını veririz. Bu reaktantların reaksiyona girmesi sonucu ise ürünler elde ederiz, bizim örneğimizde ürün, bildiğiniz üzere, su molekülüdür yani H2O.
GÖRSEL 7 Su molekülü oluşumunda reaktantlar ve ürünler

Bir kimyasal reaksiyonda reaktantların toplam hacmi ürünlerin toplam hacmine eşittir. Bu yüzden reaksiyon öncesinde ve sonrasında her elementin atomundan aynı miktarda bulunması gerekir. Önceki cümle kadar önemli bir başka cümlemiz daha var. Atomların yapısında belli başlı değişiklikler olduğu için reaktantlar ve ürünler artık farklı kimyasal özelliklere sahiptir. İnsan vücudundaki fonksiyonların sağlıklı devam edebilmesi ve vücut yapılarının oluşturulabilmesi için vücudumuzun içinde binlerce farklı kimyasal reaksiyon gerçekleşir. Gerçekleşen bütün bu kimyasal reaksiyonları ifade etmek için de metabolizma terimini kullanıyoruz. Yani, metabolizma, vücudumuzdaki bütün yapım ve yıkım reaksiyonlarını ifade eder.
3.1 Enerjinin Formları
Enerji, iş yapabilme kapasitesi demektir ve her kimyasal reaksiyonda enerji seviyesinde değişim meydana gelir. Bence bir çoğunuz biliyorsunuz, enerjinin temelde iki biçimi bulunur. Potansiyel enerji, depolanan ve harekete dönüşebilme olanağı olan enerjiyi ifade eder. Kinetik enerji ise hareket halindeki enerjiyi tanımlamak için kullanılır. Örneklendirmez gerekirse, bir barajın arkasında duran su potansiyel enerjiye sahiptir ve baraj kapılarının açılmasıyla birlikte su hareket etmeye başlar dolayısıyla suyun sahip olduğu potansiyel enerji kinetik enerjiye dönüşmüştür. Kimyasal enerji ise molekül ve bileşiklerin yapısındaki bağlarda depolanan potansiyel enerjidir. Bir kimyasal reaksiyonun başlangıcında ve sonunda bulunan enerji miktarı aynıdır. Enerji, yoktan var edilemez ve vardan yok edilemez olduğu için yalnızca bir formdan öbürüne dönüştürülebilir. Bu, enerjinin korunumu yasasıdır. Hemen buna da basit bir örnek verelim. Yediğimiz gıdaların içinde kimyasal enerji olduğunu biliyoruz. Vücudumuza gıdalarla aldığımız bu kimyasal enerjiye ne oluyor? Yürümek ve konuşmak kas hareketleri yani mekanik enerjiye ihtiyaç duyan eylemlerdir. Bu eylemlerle beraber kimyasal enerji mekanik enerjiye dönüşür. Başka bir örnek ise, enerjinin bir formdan öbürüne dönüşümü esnasında ortama salınan ısı enerjisi. Enerji formu dönüşümü esnasında ortama salınan bu ısı normal vücut sıcaklığımızı korumak için kullandığımız bir yöntemdir.
3.2 Enerjinin Aktarımı
Kimyasal reaksiyonların yeni bağların oluşumu veya var olan bağların yıkımıyla oluştuğundan bahsetmiştik. Kimyasal bağ molekülde depolanan enerjiyi ifade ettiğinden yeni bağın yapılması veya var olan bağın yıkılması ortamdaki serbest enerji seviyesini doğrudan etkileyecektir. Eksergonik reaksiyonlar neticesinde ortamdaki serbest enerji seviyesi yükselir, yani ortama enerji salınır. Başka bir ifadeyle ise molekülün yapısındaki bağlardan birisi koparılmıştır diyebiliriz. Bunun tersi olarak, endergonik reaksiyonlar ortamdaki enerji seviyesini düşürür çünkü enerjinin yeni molekülün yapısındaki bağlarda depolanmasını sağlayacaktır.
İnsan vücuduna baktığımızda endergonik ve eksergonik reaksiyonların birlikte karşımıza çıktığını görüyoruz. Yapım ve yıkım işleri vücudumuzda sürekli olarak gerçekleşmektedir. Eksergonik bir reaksiyon gerçekleşip ortama enerji saldığında serbestlenen bu enerji genelde endergonik bir reaksiyonu gerçekleştirmek için kullanılır. Enerji, bir bakıma, bir yapıdan öbürüne teansfer edilmiş olur. Eksergonik reaksiyonlar temel olarak tükettiğimiz gıdalarla gelen makro besinlerin (karbonhidrat, protein, yağ) monomerlerine parçalanmalarıyla gerçekleşenlerdir. Bu reaksiyonlarla elde edilen enerji diğer hücresel faaliyetler için kullabileceği gibi ATP molekülünün kovalent bağlarında da depolanabilir. ATP, tam adı adenozin trifosfat olan bir molekül. Bu yazını son bölümünde yapısı ve özelliklerinden bahsedilmiştir. Bu moleküle hapsedilen enerji daha sonrasında kas ve kemik gibi büyük yapıların inşaasındaki endergonik reaksiyonların gerçekleşmesi için kasların hareket oluşturmak adına kasılması için veya hücre içi ve hücreler aradı madde taşınımı için de kullanılır.
3.3 Aktivasyon Enerjisi
Şu ana kadar bahsettiğimiz atomlar, iyonlar ve moleküller kinetik enerjiye sahip çok küçük yapılardır. Kinetik enerjiye sahip oldukları için sürekli olarak hareket ederler. Bunun neticesinde de birbirleriyle çarpışıp dururlar. Kimyasal reaksiyonların gerçekleşmesi için bu çarpışmaların yeterli bir şiddette olması gerekir. Bu seviyede kuvvetli bir çarpışma sonucunda valans elektronların hareketlerinde değişiklik meydana gelir, dolayısıyla bazı bağlar yıkılır ve bazı yeni bağlar oluşur. Valans elektronların davranışlarını değiştirmek için gereken bu çarpışmanın kuvveti, şiddeti ya da seviyesi aktivasyon enerjisi olarak isimlendirilir. Bir de şöyle açıklayalım, aktivasyon enerjisi reaktantların (atomların veya moleküllerin) çarpışması esnasında sahip oldukları kimyasal bağların yıkılıp farklılaşması için gerekli enerji miktarıdır. Bu noktada kimyasal reaksiyonun gerçekleşmesi için aslında bir miktar enerji yatırımında bulunulması gerektiğini anlamış olmanız lazım. Reaktantlar, kararsız hale geçmek ve valans elektronlarıyla yeni kombinasyonlar ortaya çıkarmak için yeterli miktarda enerji emmelidir. Yeni bağlar oluştuğunda ise enerji ortama bırakılır. ATP hidrolizi için gerekli bir enerji bulunur ancak bağın potansiyel enerjisi yatırımdan daha yüksek olduğu için bu reaksiyon ortama enerji bırakır. Yaşanan çarpışmalar sonucunda kimyasal reaksiyonun gerçekleşip gerçekleşmeme olasılığı hem ortamın sıcaklığına hem de maddelerin ortamdaki konsantrasyonuna bağlıdır.
Belli bir alan içerisinde partiküllerin konsantrasyonun artması çarpışmalarının ihtimalini yükseltir dolayısıyla kimyasal reaksiyonların gerçekleşme ihtimalini doğru orantılı etkiler. Aynı alanda partikül konsantrasyonu artmadığını ancak ortamdaki basıncın arttığını farz edelim. Bu durumda partiküller konsantrasyon artışındaki gibi birbirlerine daha yakın hareket ederler.
Sıcaklığın artmasıyla birlikte madde partiküllerinin sahip olduğu hareketlilik artar. Hareketliliği artan partiküllerin çarpışmaları da daha kuvvetli gerçekleşir. Bu yüzden partiküllerin sıcaklığının artması kimyasal reaksiyon gerçekleşme olasılığını da aynı doğrultuda etkiler.
Kimyasal reaksiyonların atomlar, iyonlar veya moleküllerin birbirleriyle çarpışması sonucu oluştuğunu öğrendik. Kimyasal reaksiyonların, canlılığı devam ettirebilecek hızda gerçekleşmesini sağlayacak sıcaklık ve molekül konsantrasyonları vücut sıvılarımız içerisinde mevcut değildir. Sıcaklığı arttırmak veya reaksiyona girebilecek maddenin partiküllerinin sayısını arttırmak vücudumuzda gerçekleşecek çarpışmaları da artıracaktır, bu yüzden kimyasal reaksiyonların hızı ya da gerçekleşme oranı da artacaktır ancak bahsettiğimiz bu durumlar aynı zamanda vücut hücrelerimize zarar verebilecek potansiyele de sahiptir.
Bu durumu çözmek için katalizörler dediğimiz maddeler bulunur. Katalizörler kimyasal reaksiyonları aktivasyon enerjisini düşürerek daha önce bahsettiğimiz iki başlığın değişmesine gerek kalmadan bu işi yapar. Vücudumuzda bulunan en önemli katalizör yapılar proteinlerde detaylı bir şekilde bahsedeceğimiz enzimlerdir. Yani enzimler reaksiyonun başlaması için ihtiyaç duyulan -daha önce bahsettiğimiz- aktivasyon enerjisini azaltarak reaksiyonun çok daha kolay gerçekleşmesini sağlayan yapılardır.
GÖRSEL 8 Aktivasyon enerjisi (enzimsiz vs enzimli)

Bir kimyasal reaksiyonun gerçekleşmesini istediğinizde reaktant büyük moleküllerden oluşuyorsa bu durumda moleküllerin yalnızca çarpışmasıyla reaksiyon gerçekleşmeyebilir. Bununla beraber moleküllerin spesifik noktalarında vuruşmalar ya da çarpışmalar gerçekleşmesi gerekir. Enzimler çarpışacak olan partikülleri kimyasal reaksiyon gerçekleşebilsin diye özel bir pozisyonda tutar. Bu özel iş neticesinde reaksiyonların gerçekleşmesi mümkün kılınır. Enzimler reaksiyonların aktivasyon enerjisini düşürüp daha hızlı ve daha kolay gerçekleşmesini sağlasalar da son ürünün bir parçası olmazlar ve kendi yapılarında bir değişiklik meydana gelmez. Yaptıkları spesifik işi bitirdikleri gibi aynı işi tekrar yapmak için hazır bulunurlar. Bu yazının proteinler bölümünde enzimler daha detaylı anlatılmıştır.
3.4 Kimyasal Reaksiyon Türleri
Bir kimyasal reaksiyon gerçekleştiğinde reaksiyona giren maddelerin atomları yeniden düzenlenmiştir. Bu sebeple yeni kimyasal özelliklere sahip ürünler ortaya çıkmıştır. Yeni kimyasal özelliklere sahip ürünleri ortaya çıkartan birkaç tür kimyasal reaksiyon bulunur: Anabolik, katabolik ve değişim reaksiyonları.
3.4.1 Anabolik reaksiyonlar
İki ya da daha fazla atomun, iyonun veya molekülün daha büyük bir yapı oluşturmak için birleştirilmesi işlemlerini anabolik reaksiyonlar denir. Anabolik reaksiyonlar sentez reaksiyonları olarak da karşımıza çıkabilir. Sentez kelimesi bir araya getirmek ya da birleştirmek anlamına gelmektedir. Buna örnek olarak su molekülünü verebiliriz. Su molekülünün yapısında iki hidrojen bir oksijen atomu bulunur. Bu atomların birleşerek daha büyük bir yapı oluşturması anabolik bir reaksiyona veya sentez reaksiyonuna bir örnektir. Anabolik reaksiyonlar genellikle endergoniktir çünkü ortama saldıklarından daha fazla enerjiyi oluşturdukları üründe depolarlar. Aminoasitlerin birleştirilerek protein oluşturulması, yine, anabolik reaksiyonlara en basit örnektir.
3.4.2 Katabolik Reaksiyonlar
Katabolik reaksiyonlar büyük moleküllerin daha küçük yapılı hallerine parçalanmalarını ifade eder. Metan gazı, buna örnek olarak, katabolik reaksiyonlara maruz kaldığında bir karbon atomu ve iki hidrojen molekülü oluşumuna öncülük eder. Genel olarak baktığımızda Katolik reaksiyonların eksergonik olduğunu söyleyebiliriz. Çünkü reaksiyonun gerçekleşmesi için harcanan enerji ortama salınandan daha azdır, ortamda serbestlenen enerji miktarı reaksiyon öncesine kıyasla artık daha fazladır. Katabolik reaksiyonlara örnek olarak glukoz molekülünün on reaksiyonluk bir işlem (glikoliz: glukozun parçalanması) sonucu pirüvata kadar yıkılmasını gösterebiliriz.
3.4.3 Değişim Reaksiyonları
Yukarda bahsettiğimiz reaksiyonların aksine aslında vücudumuzda gerçekleşen reaksiyonların çoğu değişim reaksiyonlarıdır. Bahsettiğimiz bu reaksiyonlar hem anabolik hem de katabolik reaksiyonların eşzamanlı gerçekleşmesini ifade eder. Buna örneklendirmek gerekirse hidroklorik asit ve sodyum bikarbonat reaksiyonuna bakabiliriz. Bu iki yapı arasında gerçekleşen bir reaksiyonda atomların boşa çıktığını göremezsiniz yalnızca eş ya da partner değiştirdiğini görebilirsiniz. Bu reaksiyon sonrasındaki ürünler ise karbonik asit ve sodyum klorür olacaktır.
GÖRSEL 9 Kimyasal reaksiyon türleri

4. İnorganik Bileşikler ve Çözeltiler
İnorganik bileşikler genelde küçüktür ve yapılarında karbon bulundurmazlar. Bunun aksine, organik maddeler yapılarında mutlaka karbon ve çoğu zaman hidrojen barındırır ve de bunula beraber her zaman kovalent bağ yaparlar.
4.1 Su
Vücudumuzda en yaygın olan madde sudur. Birçok maddenin çözünmesine sebep olduğu için çok iyi bir çözücüdür. Hatta evrensel çözücü olarak adlandırılır çünkü en çok maddeyi çözen sıvıdır. Yapısında bulunan birçok hidrojen bağından (polar kovalent bağlar kaynaklı) ötürü de kohezyon kuvveti oluşur. Kohezyon kuvveti, su moleküllerinin birbirini çekmesi olayıdır. Bu sayede bir bardağı taşırmadan hacminden daha fazla su doldurabilirsiniz (küçük bir tavsiye olarak hareket ettirmeden önce tepeden bir yudum çekmeyi ihmal etmeyin).
GÖRSEL 10 Kohezyon kuvveti

4.2 Asitler, Bazlar ve Tuzlar
Bu maddeler suyun içinde farklı iyonlara ayrıştıkları için bu şekilde isimlendirilmiştir. Bir asit, hidrojen iyonları (H+) ve anyonlara ayrışır, bununla beraber de proton donörüdür. Birçok baz ise katyonlara ve hidroksil iyonlarına (OH-) ayrışır, hepsi proton alıcısıdır. Bir tuz ise H+ veya OH- olmayan anyon ve katyonlara ayrılır. Tuzlar asit ve bazların birleşmesi sonucu oluşur. Asit ve baz birleşirken hidrojen ve hidroksil iyonları birleşerek su molekülü ortaya çıkarır.
İnorganik asitler, bazlar ve tuzlar suyun içinde iyonlara ayrışır.
GÖRSEL 11 Asit, baz ve tuzun suda iyonlara ayrışması

GÖRSEL 12 Asit ve bazın birleşerek tuzu oluşturması
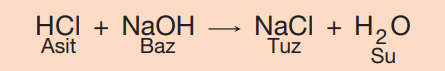
4.3 Asit-Baz Dengesi ve Tampon Sistemleri
Vücudumuzda bulunan sıvıların pH değerleri vücudun sağlıklı denge durumunu koruyabilmesi yani homeostazi için belirli bir aralıkta kalmalıdır. pH skalasında yedi (7) nötr değeri, yedinin üzeri (>7) alkalin, yedinin altı (<7) asidik çözeltileri ifade eder. Normal kan pH değerimiz ise 7.35-7.45 arasındadır.
Ortamdaki hidrojen miktarının artması ortamı asidik yapar yani pH düşer.
GÖRSEL 13 Farklı madde ve dokuların pH skalasında yeri

pH homeostazisini sağlamak adına vücudumuzda çeşitli tamponlama sistemleri bulunmaktadır. Tamponlama sistemleri hidrojen iyonlarını (H+) ortamdan alabilir veya ortama bırakabilir. Bunun en güzel örneği karbonik asit-bikarbonat tamponlama sistemidir. Bikarbonat iyonu (HCO3-) zayıf bir bazdır ve ortamdan H+ toplar, karbonik asit (H2CO3) ise zayıf bir asittir ve ortama H+ bırakır. Bu sayede ortamın pH dengesi artı veya eksi yönde kontrol edilebilir.
GÖRSEL 14 Karbonik asit-bikarbonat (reversibl reaksiyon)

5. Organik Bileşikler
Karbon, büyük moleküller meydana getirebilmek için en dış katmanında bulunan dört valans elektronu aracılığıyla diğer karbonlarla kovalent bağlar yapar. Organik bileşiklerin karbon iskeletine bağlı olan, fonksiyonel gruplar (karboksil, hidroksil, ester, fosfat, amino gibi) yapıya ayırt edici kimyasal özellikler kazandırır. Monomerler daha büyük molekülleri oluşturmak için birleşirler. Monomer, organik bileşiklerin en küçük yapı taşlarına denir. Bu tür bir olayda dehidrasyon sentezi reaksiyonu gerçekleşir yani reaksiyon esnasında ortama bir molekül su bırakılmıştır.
GÖRSEL 15 Dehidrasyon sentezi (su açığa çıkar)

Bu reaksiyonun tersi ise hidroliz reaksiyonu olarak adlandırılır. Hidroliz sonucunda büyük moleküllerden daha küçükleri elde edilir. Bu esnada ortamdan bir su molekülü alınır ve elementleri ürünleri doyurmak için kullanılır.
GÖRSEL 16 Hidroliz reaksiyonu (ortamdaki su azalır)

5.1 Karbonhidratlar
Karbonhidratlar, ATP üretimi için en çok enerjiyi sağlayan yapılardır (ATP bu yazıda en alt kısımda anlatılmıştır). Vücudun yalnızca %2-3'lük kısmını oluştururlar. Yapılarında karbon, hidrojen ve oksijen elementleri bulunur. Karbonhidratlar yapılara katılmaktan ziyade enerji üretimi için parçalanırlar ancak pentozlar (monosakkarit) yapı maddesi olarak kullanılır. Karbonhidratları boyutlarından ötürü (monosakkaritler, disakkaritler, polisakkaritler) üç (3) temel grupta inceleriz.
GÖRSEL 17 Pentozlar (deoksiriboz ve riboz)

5.1.1 Monosakkaritler
Monosakkaritler, karbonhidratların monomerleridir (en küçük yapıları) ve basit şekerler olarak adlandırılırlar. Farklı sayıda (3 ve 7 arası) karbon barındırabilirler. Bununla beraber hücrelerimizde en çok bulunan beş (5) ve altı (6) karbonlu olanlardır. Beş karbonlular pentoz ve altı karbonlular heksoz olarak adlandırılır. Glukoz, kan şekerimizi belirleyen ve bizim için en önemli olan monosakkarittir. Fruktoz meyvelerde, galaktoz ise sütte rastlanan bir karbonhidrattır. Bunların yazılı formları aynı gözükse de (C6H12O6) yapısal olarak incelendiklerinde aslında aynı olmadıkları ve bu yüzden kimyasal bağlanmalarının da farklı olduğu görülmektedir.
GÖRSEL 18 Heksozlar (glukoz, galaktoz ve fruktoz)

5.1.2 Disakkaritler
Bir disakkarit molekülü, iki monosakkaritin dehidrasyon sentezi soncunda oluşur. Tam tersi olan reaksiyon, hidroliz reaksiyonu, disakkaridi monosakkaritlere ayırır. Disakkaritleri sükroz, laktoz, maltoz olarak belirtelim. Sükroz, sofra şekeri olarak geçer ve glukoz + fruktoz reaksiyonuyla oluşur. Laktoz, süt şekeri olarak geçer ve glukoz + galaktoz reaksiyonuyla oluşur. Son olarak maltoz ise malt şekeri olarak geçer ve glukoz + glukoz reaksiyonuyla meydana gelir.
GÖRSEL 19 Disakkarit oluşumu ve dehidrasyon sentezi

5.1.3 Polisakkaritler
Polisakkarit molekülü yüzlerce ya da binlerce monosakkaridin bir araya gelmesinden oluşabilir. Selüloz, buna örnek olarak, yapısında 10.000 glukoz molekülü barındırır. Bitkilerin glukoz kullanarak ürettikleri bu polisakkarit bitki hücre duvarında bulunan yapı maddesidir. Bu yapıdaki kimyasal bağlanmayı sindirebilecek enzimler insan vücudunda bulunmadığı için insan boşaltım sisteminde sindirilemez. Buna rağmen barındırdığı liflerden ötürü sindirim yolunda mukus üretimine sebep olur ve bu sayede sağlıklı bir boşaltıma destekçidir.
İnsan vücudundaki ana polisakkarit yapısı ise glikojendir. Glikojen yalnızca glukoz monomerlerinden oluşur. Kaslarda ve karaciğerde depolanır. Karaciğer glikojen deposu kan şekerini (glukozunu) dengede tutmayı hedeflerken kaslardaki glikojen depoları yüksek ve orta şiddetli aktiviteler için vücudun hazır olmasını sağlar.
Glikojen egzersiz performansında kritik öneme sahip kısıtlı enerji depolarıdır, kaslarda ve karaciğerde depolanır.
Nişasta bir diğer polisakkarittir. Bitkilerin glukozdan elde ettikleri ve depoladıkları formdur. Pirinç, mısır, patates ve tahıllarda nişasta bulunur. Glikojen ve nişasta, disakkaritler gibi hidroliz reaksiyonu ile monosakkaritlerine ayrılabilir. Kan şekeri azaldığında, karaciğer glikojeninden ihtiyaç duyulan miktarda glukozlar koprılıp kana verilir böylece gerekli denge sağlanır.
GÖRSEL 20 Karaciğer glikojeni

5.2 Lipidler
Organik bileşiklerin bir diğer önemli grubu lipidlerdir. Bu yapılar sağlıklı yetişkinlerde vücut kütlesinin yaklaşık %18-25'ini oluşturur. Karbonhidratlarda olduğu gibi yapısında karbon, hidrojen ve oksijen bulunur ancak hidrojenin oksijene oranı karbonhidratlardakinden daha fazladır. Lipidlerin ortak bir monomerleri yoktur. Bir çok lipid suda çözünmez bu yüzden hidrofobik olarak adlandırılır.
Lipidlerin ortak çözücüleri aseton, benzen ve eter gibi organik çözücülerdir.
Hidrofobik olduklarından ötürü yalnızca en küçük yapılı lidipler (yani bazı yağ asitleri) sulu kan
plazmasında çözünebilir ve bu sayede taşınabilir. Kan plazmasında taşınmak adına daha çözünebilir hale gelmek için hidrofilik özellikli proteinlerle bir araya gelirler. Lipid ailesi temelde beş (5) grupta (yağ asitleri, trigliseritler, fosfolipitler, steroidler, eikosanoidler) incelenir.
5.2.1 Yağ Asitleri
Yağ asitleri, en küçük yapılı lipidler arasında yer alır. Trigliseritler ve fosfolipitlerin sentezinde kullanılır. Aynı zamanda ATP üretimi için daha küçük parçalara yıkılabilirler. Kimyasal yapılarında bir karboksil ve hidrokarbon zinciri bulunur. Serbest yağ asitleri doymuş ve doymamış olarak 2 grupta ele alınır.
Doymuş bir yağ asidinin hidrokarbon zincirindeki karbon atomlarının arasında yalnızca tekli kovalent bağ bulunur. İkili bağları bulunmadığı için hidrokarbon zincirinin her bir karbon atomu hidrojenlere doymuştur (örn. Palmitik asit Görsel xx).
GÖRSEL 21 Doymuş yağ asidi (Palmitik asit)

Doymamış bir yağ asidinin hidrokarbon zincirinde ise karbon atımları arasında bir veya daha fazla ikili kovalent bağ bulunur (örn. Oleik asit görsel 16). Bu yüzden yağ asidi hidrojen atomlarıyla tamamen doymamış haldedir. Doymamış yağ asitleri çift bağların olduğu kısımlarda bükülmeler yaşar. Yapısında yalnızca bir tane çift bağ bulunan yağ asidine tekli doymamış yağ asidi denir ve bu yüzden de tek bir bükülmeye sahiptir (görsel xx).
GÖRSEL 22 Tekli doymamış yağ asidi (Oleik asit)

Bununla beraber, hidrokarbon zincirinde birden fazla çift bağ barındıran yağ asitleri çoklu doymamış yağ asitleri olarak adlandırılır ve yapılarında birden fazla bükülme bulunur (görsel xx).
GÖRSEL 23 Çoklu doymamış yağ asidi (Linoleik asit)

5.2.2 Trigliseritler
İnsan vücudunda ve diyetinde en çok bulunan lipid türü trigliseritler ya da triaçilgliserollerdir (TAG). Bir gliserol molekülü ve üç yağ asidi molekülünün dehidrasyon sentezi reaksiyonuyla bağlanması sonucu oluşurlar. Her bir yağ asidinin gliserol molekülünün bir karbon atomuyla ester bağı yapmasıyla bu olay gerçekleşir. Ester bağlarının oluşumu sırasında su molekülü açığa çıkar. Tam tersi reaksiyon yani hidroliz reaksiyonu gerçekleştiğinde ise yağ asitleri gliserolden koparılır, bir (1) gliserol ve üç (3) serbest yağ asidi açığa çıkmış olur.
Oda sıcaklığındayken trigliseritler katı veya sıvı halde olabilirler. Oda sıcaklığında akışkan olmayan yağları katı yağ, tam tersi yani akışkan olan yağları ise sıvı yağ olarak isimlendiriyoruz.
Katı yağın yapısındaki yağ asitleri çoğunlukla doymuştur. Bu yağ asitlerinin hidrokarbon zincirlerinde çift bağ bulunmadığı için birbirlerine çok yakın yapıda olabilirler işte bu yüzden oda sıcaklığında katı bir forma bürünürler. Tereyağı, peynir, kırmızı ette bulunan yağ buna örnektir.
Yüksek miktarda doymuş yağ içeren diyetler kalp-damar hastalıkları ve kolorektal kanser ile ilişkilendirilmiştir.
Sıvı yağ, oda sıcaklığında sıvı formunu koruyan trigliserittir. Sıvı yapıyı oluşturan yağ asitlerinin çoğunluğu doymamış yağ asitleridir. Doymamış yağ asitlerinin tekli veya çoklu doymamış olabileceklerini bir hatırlatalım. Hidrojene doymamış karbonlar arasında çift bağlanma ve hidrokarbon zincirinin bu bölgelerinde bükülmeler meydana geliyordu. Bu bükülmeler, yağ asitlerinin birbirlerine çok yakınlaşmasını engellediği için oda sıcaklığında katılaşmasını önlemektedir dolayısıyla sıvı halde kalmalarını sağlar.
Tekli doymamış sıvı yağlar çoğunlukla tekli doymamış yağ asitlerine sahip trigliseritler yapısında barındırır (örn. zeytinyağı, yer fıstığı yağı, kanola yağı). Çoklu doymamış sıvı yağlar ise çoklu doymamış yağ asitlerine sahip trigliseritleri yapılarında barındırırlar (örn. mısır yağı, ayçiçek yağı, balık yağı).
Trigliseritler vücudumuzda adipoz dokuda depolanır ve bu depo için bir sınır bulunmamaktadır. Gram başı hesap yapıldığında trigliseritler hem proteinler hem de karbonhidratlara kıyasla iki (2) kattan daha fazla enerji sağlar. Diyet ile alınan fazlalık makro besinlerin (protein, yağ, karbonhidrat) tamamının kaderi aynıdır. Adipoz dokuda trigliserit olarak depolanırlar. Depolanan trigliseritler enerji sağlamak amacıyla kullanıldığı gibi organlara ve vücudun diğer dokularına yalıtım ve koruma sağlamaktan da görevlidir.
5.2.3 Fosfolipidler
Yapısal olarak trigliseritlere çok benzerler. Ancak trigliseritin aksine gliserolün üçüncü karbonuna yağ asidi değil fosfat grubu bağlıdır. Bu fosfat grubunda elektriksel olarak küçük bir yük bulunur. Molekülün bu kısmı polar özelliğe sahiptir ve su molekülleriyle zayıf hidrojen bağları oluşturabilir. Başın aksine kuyrukta bulunan yağ asitleri nonpolar özelliktedir ve yalnızca diğer lipitlerle etkileşime geçebilir. Baş kısım suyu seven (hidrofilik), kuyruk kısım ise sudan korkan (hidrofobik) özelliktedir.
Bunun gibi hem hidrofilik hem de hidrofobik yapısı bulunan moleküller amfipatik olarak adlandırılır. Bu özelliğinden ötürü hücre içi ve dışı sıvısının birbirine karışmasını engeller. Amfipatik fosfolipidler, her bir hücreyi saran hücre zarının büyük çoğunluğunu oluşturmak için çift sıra halinde kuyruk kuyruğa (yani yağ asidi yağ asidine, başlar sıvı kısımlara dönük) sıralanır bu sayede membranın büyük çoğunluğunu oluştururlar.
GÖRSEL 24 Fosfolipidin ve trigliseridin yapısal farkı

GÖRSEL 25 Fosfolipidin hücre zarındaki duruşu

5.2.4 Steroidler
Steroidler birbirine bağlı dört hidrokarbon halkasından oluşan lipid yapılardır. Farklı tip lipidler birbirlerinden yapısal olarak farklılık gösterir. Hidrokarbon halkasına bağlanan fonksiyonel grup ve halkalarda bulunan çift bağların konumları farklılığı sağlayan şeylerdir. Steroidlere örnek olarak kolesterol, östrojen, testosteron ve D vitamini verilebilir.
GÖRSEL 26 Steroid yapılı iki hormon: Testosteron ve estradiol

Bu yapıların (steroidler) insan vücudunda çok önemli rolleri bulunur. Kolesterol hücre zarı yapısına katılır, östrojen ve testosteron cinsel fonksiyonların düzenlenmesi için gereklidir, D vitamini ise kemik gelişimine katkı sağlar.
5.2.5 Eikosanidler
Eikosanoidler, araşidonik asit adı verilen ve yapısında 20 karbon barındıran yağ asidinden türetilen lipidlerdir. Temelde üç alt gruba ayrılır (prostaglandingler, tromboksanlar, lökotrienler). Prostaglandinler, bu kadarla sınırlı kalmamakla beraber, hormon yanıtları düzenler, inflamatuar yanıtta rol alır ve akciğer yollarını genişletir. Tromboksanlar damarları daraltır(vazokonstriksiyon) ve trombositlerin aktivitesini sağlar. Lökotrienler ise alerjik ve inflamatuar yanıtlara katılır. Hücreler arası iletişimdeki görevlerinden ötürü eikosanoidlere TEMEL FİZYOLOJİ 5 yazısında daha detaylı yer verilmiştir.
5.3 Protein
Proteinler yapılarında karbon, hidrojen, oksijen ve nitrojen barındıran büyük boyutlu moleküllerdir. Bazı proteinlerin yapısında sülfür de bulunabilir. Sağlıklı bir yetişkin vücudunda yaklaşık olarak %12-18 arası protein bulunur. Yapısal olarak değerlendirildiklerinde karbonhidratlar ve yağlara kıyasla daha komplekstirler. Birçok farklı fonksiyonu bulunan proteinlerin sorumlu olduğu en büyük rol vücut dokularına yapısal destek sağlamaktır.
Enzimler protein yapılıdır ve kimyasal reaksiyonları hızlandırıp gerçekleşmesini sağlarlar. Taşıyıcı proteinler hücre zarında veya vücudun bir noktasından öbür noktasına maddelerin taşınmasını sağlar. Kas kasılmasını dolayısıyla hareketi sağlayan aktin ve miyozin isimli yapılar birer proteindir. Son örnek olarak, vücudumuzu işgal eden mikroplara karşı bizi koruyan antikorlar protein yapılardır.
5.3.1 Amino Asitler ve Polipeptitler
Amino asitler, proteinlerin monomerleridir. 20 farklı çeşitte amino asit bulunur. 20 farklı amino asidin hepsinde bir hidrojen atomu, bir karboksil grup, bir amino grubu ve bir de radikal grup bulunur. Amino asitlere farklı özellikleri kazandıran şey radikal grubun değişkenliğidir (görsel xx).
GÖRSEL 27 Amino asitleri ayıran radikal (R) kısım örnekleri

Protein sentezi, amino asitlerin birer birer birbirlerine eklenmesiyle gerçekleşir. Amino asitleri birbirine bağlayan kovalent bağa peptid bağı denir. Bu bağ her zaman aynı iki noktada gerçekleşir, bir amino asidin karboksil grubunun karbonu ve öbür amino asidin amino grubunun nitrojeni (görsel xx). Peptid bağı oluşurken dehidrasyon senteziyle bir molekül su açığa çıkar. Buna zıt olarak diyetle alınan proteinleri oluşturan amino asitler arasındaki peptid bağlarının sindirimde yıkılması hidroliz reaksiyonudur.
GÖRSEL 28 Peptid bağıyla amino asitlerin birleşmesi

İki amino asidin birleşmesi sonucu dipeptid ortaya çıkar. Üçüncü bir amino asidin eklenmesiyle tripeptid, dört (4) veya daha fazla amino asidin birleşmesiyle polipeptit zincirleri oluşur. Küçük yapılı proteinler 50 amino asitten oluşan tek bir polipeptit zincirinden meydana gelebilir. Büyük yapılı proteinler ise binlerce amino asitten ve birbirine katlanmış olan iki ya da daha fazla polipeptid zincirinden oluşabilir (görsel xx).
GÖRSEL 29 4 ayrı polipeptid zincirli hemoglobin

Proteinleri farklı kılan şey amino asitlerin sayısı ve sıralamasında değişikliktir. Burada en güzel benzetme alfabedir. Amino asitlerin alfabedeki harfler olduğunu bir hayal edin. Bu durumda, yirmi (20) harflik bir alfabeyle inanılmaz büyük çeşitlilikte kelime hazinesi ya da gerçek anlamda peptid, polipeptid ve protein oluşturabilirsiniz.
5.3.2 Proteinlerde Yapısal Organizasyon Seviyeleri
Proteinler dört (4) seviyeli bir yapısal organizasyona sahiptir. Primer yapı kendine özgü amino asit diziliminden oluşan bir polipeptid zinciridir ve tek boyutludur. Bir proteinin primer yapısı genetik olarak belirlidir, bu yapının amino asit diziliminde meydana gelen herhangi bir değişiklik hücre için ciddi sonuçlar doğurabilir.
Kanda oksijeni taşımaktan sorumlu olan protein yapılı hemoglobinin amino asit diziliminde meydana gelen değişim önceki cümlemize örnek verilebilir. Valin yerine glutamat amino asidinin gelmesiyle oluşan bu hastalıkta hemoglobinin suda çözünebilirlik özelliği neredeyse yok olur. Sonuç olarak bütün dokuların ihtiyacı olan oksijenin taşınmasında ciddi aksama meydana gelir.
Sekonder yapıya bakıldığında iki boyutlu olduğu görülür. Polipeptid zincirinin sarmal şeklinde kıvrılması sonucu bahsedilen iki (2) boyutlu yapı elde edilir. Sarmalda birbiri üstüne gelen amino asitler arasında hidrojen bağları kurulur. Bu hidrojen bağları sekonder yapının stabilitesini sağlar.
Tersiyer yapı polipeptid zincirinin üç (3) boyutlu şeklini ifade eder. Proteinlerin tersiyer yapıları nasıl bir fonksiyona sahip olacaklarına göre değişkenlik gösterir yani fonksiyona özeldir. Bu yapı, polipeptid zincirinin iki (2) uç noktasında bulunan amino asitleri komşu amino asitler kadar yakınlaştırabilir. Tersiyer yapıya destek sağlayan birden fazla bağ çeşidi bulunur. İki monomerin sülfidril grupları arasındaki disülfit köprüleri, hidrojen bağları, iyonik bağlar ve hidrofobik etkileşimler bu yapı oluşumunda yardımcıdır.
Birden fazla polipeptid zinciri içeren proteinlerde her bir zincirin bir diğerine göre olan düzeni kuaterner yapıyı ifade eder. Bu yapıda polipeptid zincirlerini birlikte tutan bağlar tersiyer yapıdakilere benzerdir.
GÖRSEL 30 Primer, sekonder, tersiyer ve kuaterner yapı

Proteinler yapısal anlamda çok ciddi çeşitliliğe sahiptir. Farklı proteinlerin hem mimarileri hem de üç boyutlu yapıları farklıdır. Bu sayede spesifik görevlerin gerçekleştirilmesi sağlanır. Bir hormonun her hücreye etki etmesini istemeyiz bu yüzden hedef hücrede o hormonun yapısını tanıyacak ve onu bağlayacak spesifik yapıda proteinlere ihtiyaç vardır. Bu sayede hormon hedef hücrede gerekli değişimlerin meydana gelmesini sağlayabilir.
Proteinler genel şekilleri açısından değerlendirildiğinde iki (2) gruba ayrılır: fibroz ve globular. Fibroz proteinler suda çözünmez, ve polipeptid zincirleri uzun teller şeklinde birbirine paralel yapıdadır. Bu özelliklerinden dolayı bir çok yapısal fonksiyonları bulunur. Kemiklere, bağlara ve tendonlara kuvvet kazandıran kolajen; deriye, kan damarlarına ve akciğer dokusuna esneklik kazandıran elastin; kıllarla tırnakların yapısını oluşuturan ve deriye su geçirmez özellik veren keratin; kas liflerinin önemli bir destekçisi olan distrofin; kas liflerinin kasılmasını sağlayan aktin ve miyozin fibroz proteinlere örneklerdir. Globular proteinler ise suda bir nebze de olsa çözünürler, polipeptid zincir yapıları küresel (globular) şekildedir. Globular proteinler, metabolik fonksiyonları bulunan proteinlerdir. Kimyasal reaksiyonları kolaylaştıran enzimler, hastalığa karşı koruyan antikorlar, oksijen taşıyan hemoglobinler, lipid ve kolesterol taşıyan lipoproteinler, hücre içi ve dışına madde taşıyan zar proteinleri globular proteinlere örneklerdir.
Homeostatik mekanizmalar vücut ısısını ve vücut sıvılarının kimyasal kompozisyonunu dengede tutar. Bu sayede proteinler üç (3) boyutlu fonksiyonel yapılarını koruyabilir. Eğer bir protein değişmiş bir çevreyle karşılaşırsa karakteristik yapısını kaybedebilir, proteinin karakteristik yapısını kaybetmesine denatürasyon denir. Denatüre olmuş proteinler fonksiyonelliğini kaybeder. Buna en basit örnek kızarmış yumurtadır. Çiğ yumurtanın beyazında bulunan çözünebilir protein albumin sıcağa maruz kaldığında denatürasyona uğrar, çözünemez bir yapıya bürünür ve beyaz rengi alır.
GÖRSEL 31 Protein denatürasyonu

5.3.4 Enzimler
Canlı hücrelerde kimyasal reaksiyonları kolaylaştıran katalizörler enzim olarak adlandırılan protein yapılardır. Bazı enzimler iki parçadan oluşabilir; protein kısım olan apoenzim ve protein olmayan kısım kofaktör (demir, çinko, magnezyum, kalsiyum). Bazı enzimler ise yapılarında kofaktör yerine koenzim barındırabilir. Koenzimler vitaminlerden elde edilen kısımlardır.
Enzimlerin isimleri genelde "-az" ekiyle sonlandırılır ve katalizledikleri reaksiyonların türüne göre gruplandırılırlar. Oksidazlar oksijen ekler, kinazlar fosfat ekler, dehidrogenazlar hidrojen alırlar, ATPaz ATP'yi böler, anhidrazlar su alır, peoteazlar proteinleri yıkar, lipazlar trigliseritleri yıkar gibi gibi bahsedelim.
1000 enzimden daha fazlasının vücudumuzda olduğu bilinmektedir ve bunların hepsinin yapısı kendine özgüdür. Enzimlerin yüzey konfigürasyonları spesifik olduğundan belli subatratları tanıyıp bağlamalarını sağlar. Reaksiyonu katalize eden bu spesifik yüzey alan aktif kısım olarak isimlendirilir. Aktif kısım substratla anahtar-kilit ilişkisi kurabilir veya substrat geldiğinde yapısal bir değişime uğrayıp substratı saracak bir hale gelebilir. İkinci durum substratla indüklenen uyum olarak ifade edilir.
Enzim spesifik bir maddeyle spesifik bir reaksiyonu katalize eder, ya substratı parçalar ya da başka bir substratla birleştirir. Bu noktada tekrar basit bir ifade için şu soruyu soralım: Ürün veya ürünler nasıl meydana gelir? Enzimlerin kendilerine özel substratlara etki ederek reaksiyonu gerçekleştirmeleri sonucu ürün ya da ürünler oluşur ancak enzimler asla kendi yapılarından bir şeyi ürüne katmazlar. Aynı substratta aynı etkiyi yaratmak için tekrar iş yapmayı bekler.
Enzimler çok verimli çalışır. Optimum şartlar sağlandığında enzim etki ettiği reaksiyonu (enzimsiz duruma kıyasla) 100 milyon kat hızlandırabilir. Bir enzimin bir saniyede aynı tür substrattan ürün elde edebilme hızı genelde 1 ile 10.000 arasında değişmektedir. Bu değer 600.000e kadar artabilir.
Enzimler çeşitli hücresel kontrollere bağlı fonksiyon gören yapılardır. Sentezlenmeleri ve anlık konsantrasyonları hücrenin genleri kontrolü altındadır. Hücre içinde bulunan maddeler de aynı zamanda enzimin aktivitesini artırabilir veya azaltabilir. Bir çok enzimin hücre içinde aktif ve inaktif formları bulunmaktadır. Hangi enzimin hangi oranda aktiften inaktife veya inaktiften aktif forma geçeceğini hücre içindeki kimyasal çevre belirlemektedir.
Enzim Nasıl Çalışır
- Substrat enzimin aktif kısmıyla temas eder. Enzim-substrat kompleksi oluşur.
- Substrat moleküllerinin atomlarının yeniden düzenlenmesiyle ürün(ler) elde edilir. Ürün oluşumunda substrat parçalanabilir veya substratlar birleştirilebilir. Elimizdeki ürünler: fruktoz ve glukoz.
- Reaksiyon tamamlandıktan sonra ürünler enzimden uzalaştırılır, herhangi bir değişikliğe uğramamış olan enzim yemi bir substrata etki etmek için hazırdır.
GÖRSEL 32 Aktif kısım ve enzim-substrat kompleksi

Bazı enzimler reaksiyonu çift yönlü olarak gerçekleştirebilir (reversibl). Bu noktada reaksiyonun yönü ortamdaki substrat ve ürünlerin miktarlarıyla belirlenir. Egzersiz esnasında çok fazla miktarda CO2 üretilip kana verilir. Bu durumda kandaki CO2 miktarını azaltmak için karbonik anhidraz reaksiyonu sağa doğru gerçekleşir (ürün: karbonik asit). Bu sayede kan CO2 seviyesi azaltılır. Buna ek olarak, CO2 ekspirasyonla (nefes verme) da vücuttan uzaklaştırıldığından kandaki miktar normal aralıktan daha aza inebilir. Bu durumda da karbonik anhidraz reaksiyonu sola doğru gerçekleşir (ürün: CO2 H2O). Ortamdaki substrat ve ürün miktarı çift yönlü reaksiyonlarda bu şekilde bir düzenleme sağlar.
5.4 Nükleik Asitler
Nükleik asitler, hücrenin çekirdeğinde (nükleusunda) keşfedilen bu yüzden de bu şekilde adlandırılan büyük yapılı organik moleküllerdir. Yapılarında karbon, hidrojen, oksijen, nitrojen ve fosfor bulunur ve iki çeşitten oluşur: deoksiribonükleik asit (DNA), ribonükleik asit (RNA).
DNA her insan hücresinin içinde genetik kalıtsal materyali oluşturur. Gen olarak ifade edilen şey DNA molekülünün segmentlerini ifade eder. Genlerimiz her şeyden önce bize miras kalan özellikleri belirler. Bunun yanında çok çeşitli yapı ve görevleri olan proteinlerin sentezini kontrol ederek tüm canlılığımız boyunca hücrelerimizde meydana gelen aktiviteleri düzenler. Bir hücre bölündüğü takdirde kalıtsal bilgileri bir sonraki nesil hücrelere aktarılır. En başta ismini belirttiğimiz gibi bir diğer nükleik asit türü olan RNA ise protein sentezinden sorumludur. Genlerden aldığı talimatlar doğrultusunda her bir hücreye amino asitlerden protein sentezini sağlamak için rehberlik eden yapılardır.
Nükleik asit, monomeri olan nükleotidlerin tekrar tekrar birleşmesi sonucu oluşur. Her bir DNA nükleotidinde üç (3) kısım bulunur:
- Nitrojen yapılı baz. DNA'da dört farklı nitrojenli baz bulunur (adenin (A), timin (T), guanin (G), sitozin (C)). Adenin ve guanin büyük yapılı ve çift halkalıdır, pürinler olarak adlandırılır. Guanin ve sitozin daha küçük yapılı ve tek halkalı bazlardır, primidinler olarak isimlendirilir. Nükleotitler içerdikleri bazlar ile adlandırılırlar, örnek olarak timin içeren nükleotid timin nükletidi olarak ifade edilir.
- Pentoz şeker. Karbonhidratlarda bahsedilen beş karbonlu şeker olan pentozlardan deoksiriboz DNA'nın her bazına bağlanır.
- Fosfat grubu. DNA ipliğinin iskeletini oluşturmak için fosfat grubu, diğer nükleotidin pentoz şekerlerine bağlanır. Bu sayede şeker-fosfat iskeleti DNA'nın uzamasına ya da büyümesine olanak tanır. Bazlar ise bu şeker-fosfat iskeletinden içeri doğru çıkıntı yapar.
GÖRSEL 33 Pürinler ve primidinler

DNA, çift sarmal olarak isimlendirilen ve spiral yapıda bir merdivene benzeyen döndürülmüş ya da bükülmüş iki iplikten oluşur. Her bir ipliğin yapısında nükleotidler bulunur. Bu nükleotidler karşı ipliğin nükleotidlerine hidrojen bağlarıyla bağlanmış haldedir. Bütün nükleotidlerin yapısında pentoz şekere bağlı bir fosfat ve dört (4) farklı nitrojenli bazdan (adenin, timin, guanin, sitozin) biri bulunur. İki iplik karşı karşıya durduğu için bu bazlardan adenin her zaman timinle, guanin ise her zaman sitozinle eşli haldedir. Bu eşleşmeler her zaman bu şekilde gerçekleştiği için eğer bir ipliğin dizilimini biliyorsanız öbür ipliğinkini de kolaylıkla bulabilirsiniz demektir. Canlı hücreler çoğalmak için bölündüklerinde çift sarmallı DNA iplikleri birbirinden ayrılır. Bu durumda her bir iplik ikincinin yapımını sağlar. DNA baz diziliminde meydana gelen herhangi bir değişikliğe ise mutasyon denir. Bazı mutasyonlar hücre ölümüne bazıları kansere bazıları ise gelecek nesiller için genetik defektlere sebep olabilir.
GÖRSEL 34 DNA sarmalı

Nükleotidlerin bir diğeri olan RNA, DNA'dan bir kaç yönden ayrışır. İnsan yapısında RNA'lar tek ipliklidir. Yapısında deoksiriboz yerine pentoz şekeri bulunur ve primidin bazlardan olan timin (T) yerine urasil (U) vardır. DNA hücre çekirdeğinde ve mitokondride yer alırken üç farklı tipte RNA (mesajcı RNA, ribozomal RNA, transfer RNA) karşımıza çıkmaktadır. DNA'da saklanan bilgilerden proteine olan süreçte, bu üç farklı yapının kendine spesifik görevleri bulunmaktadır.
Adenozin Trifosfat (ATP)
Adenozin trifosfat (ATP) hücrenin ya da yaşayan sistemlerin enerji kaynağıdır. ATP, ekzergonik katabolik reaksiyonlarda serbest bırakılan enerjiyi, enerji harcanmasını gerektiren hücresel aktivitelere (endergonik reaksiyonlar) aktarır. Peki sizce enerji harcanmasını gerektiren bu hücresel faaliyetlere neleri örnek verebiliriz? Bedenimizi hareket ettirmek için hücresel boyuttaki yapıların (kas liflerinin) gerçekleştirdiği kasılmalar, hücre bölünmesi esnasında kromozomların gerçekleştirdiği hareketler, hücre içinde bulunan çeşitli yapıların yer değiştirmeleri, hücre zarı boyunca maddelerin taşınması ve küçük molekülleri birleştirerek büyük molekülleri elde etme çabaları en temel örneklerdir.
ATP, isminden de anlaşıldığı üzere yapısında adenozine bağlı üç (3) adet fosfat grubundan oluşmaktadır. Adenozin ise adenin ve beş karbonlu şeker olan ribozdan meydana gelmektedir.
GÖRSEL 35 Adenozin Trifosfat (ATP)

ATP'ye bir su molekülü eklendiği takdirde üçüncü fosfat grubu yapıdan koparılır. Bu reaksiyon neticesinde de ATP'nin yapısında barındırdığı enerji serbest bırakılır. Bu olayı yani ATP hidrolizini katalizleyen enzime ATPaz enzimidir. Üçüncü fosfat grubunun koparılmasıyla iki fosfatlı bir yapı elde edilir. Bu yapıya adenozin difosfat (ADP) ismi verilmektedir.
GÖRSEL 36 ATP hidrolizi

Hücreler ATP'nin ADP'ye yıkılarak enerji saldığı reaksiyonu (ATP hidrolzi) sürekli olarak gerçekleştirmektedir. Bu bağlamda ATP'nin bir noktada bitmesi gerektiğini düşünebilirsiniz. Bu yüzden ATPaz'ın yaptığı eylemin tersini gerçekleştiren bir mekanizma bulunmaktadır. ATP sentaz isimli enzim ADP'nin yapısına üçüncü fosfatın eklendiği reaksiyonu katalize ederek ATP'nin üretilmesini sağlar.
Bu noktada ikinci bir soru sorulması gerekebilir. Hücre ATP üretimi için gerekli enerjiyi nereden buluyor? Glukoz ve yağ asitlerinin katabolizmasıyla (glikoliz ve beta-oksidasyon) ATP üretimi için gerekli enerji elde edilir. ATP üretimi için gerçekleştirilen bu katabolik reaksiyonlara da hücresel solunum ismi verilir. Hücresel solunum aerobik ve anaerobik olmak üzere iki fazdan oluşur.
Anaerobik faz, reaksiyonlarında oksijen varlığına ihtiyaç duyulmadığı için bu şekilde adlandırılır. Bu fazda altı karbonlu glukoz molekülü adeta ortadan ikiye bölünmüş bir hale geçer ve son ürün olarak 3 karbonlu bir yapı olan pirüvattan iki tane meydana gelir. Glukozdan pirüvata olan bu on (10) reaksiyonluk süreçte oksijene ihtiyaç duyulmaz ve iki (2) adet ATP molekülü elde edilir.
Aerobik faz, glukoz molekülünün karbondioksit ve su moleküllerine kadar tamamen parçalandığı fazdır. Bu olayların tamamlanabilmesi için ortamda oksijen gereklidir. Aerobik faz neticesinde ısı üretilir ve 30-32 ATP molekülü elde edilir.
Neler Öğrendik
- Atomun yapısını,
- Vücudumuzda en yaygın olan elementleri,
- Serbest radikalin ne olduğunu,
- İyonik ve kovalent bağları ve bunların nasıl oluştuğunu,
- Reaktant, ürün ve reversibl terimlerini,
- Kimyasal bağların nasıl oluştuğunu,
- Anyon ve katyonlara iyon dendiğini,
- Organik ve inorganik terimlerini,
- Kohezyon kuvvetiyle su moleküllerinin birbirine tutunduğunu,
- Asit, baz ve tuz terimlerini,
- Kan pH değeri ve pH sakalasını,
- pH, tamponlama sistemleri ve homeostaziyi,
- Bikarbonat ve karbonik asit etki mekanizmalarını,
- Tamponlama sisteminin ne yaptığını ve farklı tamponlama sistemleri bulunduğunu,
- Dehidrasyon ve hidroliz tepkimelerinin su molekülleriyle ilişkisini,
- Adenozin trifosfatın (ATP) hücrenin enerji kaynağı olduğunu,
- Karbonhidrat, yağ ve proteinlerin temel yapı ve işlevlerini,
- Temel düzeyden DNA ve RNA yapılarını,
- ATP'nin yapısını, hidrolizini ve nasıl enerji sağladığını öğrendiniz.
Bu yazı SSPS spor ve sağlık bilimleri kütüphanesindeki kaynaklardan yararlanarak hazırlanmıştır.



